Sous la surface de l’imagerie médicale, l’angiogenèse se révèle comme un chef d’orchestre invisible qui dirige la croissance et la transformation des tissus humains. Des premières divisions cellulaires lors du développement embryonnaire, jusqu’aux réponses réparatrices qui suivent une blessure, le réseau des vaisseaux sanguins apparaît au cœur des processus vitaux. Pourtant, ce mécanisme physiologique, fondamental à notre survie, porte également une face sombre lorsqu’il est détourné par des tumeurs pour assurer leur progression. Comprendre les rouages de l’angiogenèse ne se résume pas à en saisir la définition : il s’agit de percer les secrets d’une bataille qui se déploie à l’échelle microscopique, mais dont les conséquences redéfinissent les perspectives de la médecine contemporaine.
Les percées scientifiques réalisées ces dernières années permettent d’analyser l’angiogenèse sous un angle inédit : celui de la confrontation entre l’ordre physiologique et la désorganisation pathologique. C’est dans ce contexte que s’inscrivent les stratégies thérapeutiques ciblant la vascularisation tumorale, où la finesse d’une approche scientifique doit répondre à la complexité d’une biologie en évolution permanente. Des facteurs de croissance comme le VEGF aux concepts plus récents de mimétisme vasculaire ou d’effondrement des barrières endothéliales, la dynamique tumorale impose aux chercheurs d’explorer chaque détail, chaque anomalie. Face au potentiel thérapeutique, une question demeure : comment dompter un phénomène qui, bien que central à la vie, façonne aussi insidieusement la maladie ?
- L’angiogenèse désigne la formation de nouveaux vaisseaux sanguins à partir de structures préexistantes, phénomène central dans le développement embryonnaire, la cicatrisation et la progression tumorale.
- Le « switch angiogénique » marque l’entrée d’une tumeur dans une phase de croissance tumorale accélérée grâce à la dérégulation des signaux activateurs et inhibiteurs de la néo-vascularisation.
- La vascularisation tumorale se distingue par des vaisseaux dilatés, perméables et structurés de façon anarchique, souvent dépourvus de péricytes et marqués par un déficit des jonctions entre cellules endothéliales.
- Les avancées thérapeutiques ciblant l’angiogenèse ouvrent la voie à de nouveaux traitements contre le cancer, mais l’efficacité demeure dépendante de la compréhension fine des mécanismes et du microenvironnement tumoral.
- Des défis persistent concernant l’observation, l’analyse et la modélisation des processus d’angiogenèse tumorale pour des applications cliniques efficaces à large échelle.
Définition et rôle fondamental de l’angiogenèse dans la physiologie humaine
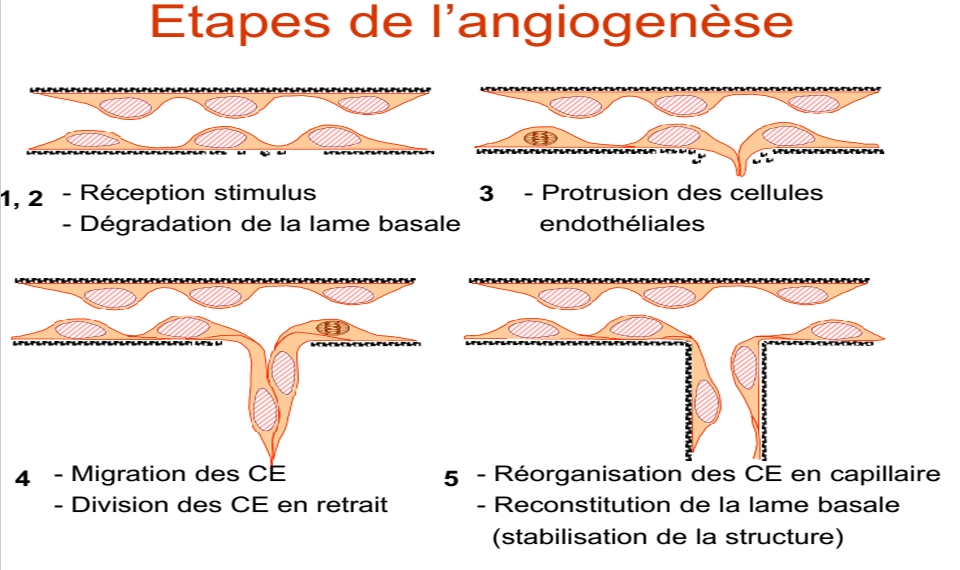
L’angiogenèse se définit comme le processus par lequel de nouveaux vaisseaux sanguins émergent à partir d’un réseau vasculaire préexistant. Ce phénomène, loin d’être marginal, s’active lors de plusieurs phases essentielles de l’existence humaine. Durant le développement embryonnaire, il assure la mise en place de circuits qui transporteront l’oxygène et les nutriments aux cellules en formation. Plus tard, lors d’une blessure, l’angiogenèse intervient pour orchestrer une cicatrisation efficace en acheminant les substances nécessaires à la réparation tissulaire. Ces fonctions vitales confèrent à ce mécanisme une dimension incontournable dans la préservation de l’intégrité de l’organisme.
Mais si, dans ces situations, l’angiogenèse demeure un processus finement régulé, sa dérégulation peut basculer dans la pathologie. En effet, la formation anarchique de vaisseaux sanguins contribue à des maladies telles que le cancer ou certaines rétinopathies. Ainsi, l’équilibre entre signaux stimulants et inhibiteurs, reçu en permanence par les cellules endothéliales – qui composent la paroi interne des vaisseaux – représente une clef de voûte de la physiologie. Les facteurs de croissance comme le VEGF (facteur de croissance de l’endothélium vasculaire) illustrent cette délicate harmonie, activant ou freinant la création de nouveaux capillaires selon les besoins de l’organisme. L’angiogenèse s’apparente alors à un lame de couteau à double tranchant : support de la vie comme de la maladie.
Mécanismes cellulaires et moléculaires de l’angiogenèse tumorale
Lorsqu’une tumeur émerge, sa croissance initiale demeure limitée par l’absence de nouveaux vaisseaux : passée une taille critique de 2 à 3 mm, la diffusion de l’oxygène devient insuffisante et les cellules centrales entrent en état de dormance. Dans ce contexte, l’équilibre entre la prolifération et l’apoptose maintient la masse tumorale stable, un phénomène parfois observé dans des lésions précancéreuses indolentes. Cependant, au fil du temps, la pression de l’hypoxie et des signaux métaboliques provoque un basculement décisif appelé « switch angiogénique ».
Ce basculement résulte d’un déséquilibre en faveur des signaux pro-angiogéniques, dont le plus emblématique demeure le VEGF. Sous l’effet de l’hypoxie et d’autres stimuli (acide lactique, fibronectine du microenvironnement), les cellules tumorales sécrètent une panoplie de facteurs qui recrutent et stimulent les cellules endothéliales des vaisseaux voisins. Ces dernières acquièrent alors une capacité accrue à dégrader la matrice extracellulaire grâce à des enzymes comme les métalloprotéinases et collagénases, ouvrant ainsi la voie à la migration et à la formation de nouveaux vaisseaux orientés vers la tumeur.
Trois modes majeurs d’angiogenèse tumorale se distinguent :
- Bourgeonnement vasculaire : extension de cellules endothéliales à partir de capillaires préexistants.
- Mimétisme vasculaire : imitation structurale des vaisseaux par des cellules tumorales elles-mêmes.
- Invagination ou division vasculaire : duplication et remodelage de segments vasculaires existants.
Chacun de ces modes possède des conséquences sur l’agressivité de la tumeur : le mimétisme, par exemple, accentue la capacité d’évasion métastatique, brouillant les pistes des traitements homéostasiques classiques. L’enjeu réside donc dans la compréhension approfondie et la modulation de ces voies, enjeu central des laboratoires d’oncologie moderne.
| Étape du processus | Composantes principales | Impact sur la tumeur |
|---|---|---|
| Prolifération des cellules endothéliales | VEGF, facteurs de croissance | Nouveaux vaisseaux orientés vers la masse tumorale |
| Dégradation de la matrice | Métalloprotéinases, collagénases | Facilite la migration cellulaire |
| Mimétisme vasculaire | Cellules tumorales | Renforce l’agressivité, échappe aux traitements classiques |
Caractéristiques spécifiques des vaisseaux sanguins dans la croissance tumorale
La vascularisation qui accompagne le développement d’une tumeur invasive n’a rien de « normale » : les vaisseaux sanguins nouvellement formés se montrent dilatés, à la fois plus perméables et plus fragiles que leurs homologues physiologiques. Cette spécificité tient à un défaut marquant de couverture en péricytes et cellules musculaires lisses sur leur paroi. Les cellules endothéliales perdent progressivement des jonctions essentielles, notamment la VE-cadhérine, affaiblissant davantage l’étanchéité vasculaire.
Le résultat de cette désorganisation se manifeste par un apport sanguin irrégulier, une oxygénation hétérogène des tissus tumoraux et une tendance marquée à l’œdème. Contrairement à l’angiogenèse physiologique, brève et régulée, l’angiogenèse tumorale est continue, alimentée par un flux constant de signaux proangiogéniques et de populations cellulaires réactives. Cela génère un environnement favorable aux phénomènes de croissance tumorale rapides, mais aussi à la dissémination métastatique via les brèches vasculaires.
Pour illustrer, l’hôpital universitaire de Lyon mène depuis 2025 une étude sur les vaisseaux sanguins tumoraux du glioblastome : la perte totale de péricytes expose ces vaisseaux à une extrême instabilité, contribuant à la résistance thérapeutique de ce cancer cérébral. D’autres travaux, menés cette fois sur des cancers solides d’origine digestive, montrent que le stroma qui entoure la tumeur participe lui aussi activement à la formation de ces néo-vaisseaux, en sécrétant des molécules attractives pour les cellules endothéliales.
Différences entre angiogenèse physiologique et angiogenèse tumorale
Il importe de distinguer clairement l’angiogenèse qui se déploie lors de processus ordinaires – telle la régénération musculaire après blessure – de celle observée dans les cancers. La première se solde par la formation de microvaisseaux stables, bien organisés, capables de remplir durablement leur fonction de transport. À l’opposé, l’angiogenèse tumorale aboutit à des réseaux désordonnés, faits de canaux souvent inachevés, responsables de fuites et d’une inefficacité circulatoire globale. Ce contraste joue un rôle clé dans la manière de cibler les cellules impliquées et d’envisager la réponse aux traitements innovants.
| Caractéristiques | Angiogenèse physiologique | Angiogenèse tumorale |
|---|---|---|
| Durée | Transitoire | Continue |
| Organisation | Ordonnée, stable | Désorganisée, instable |
| Cellules de soutien (péricytes) | Présentes | Souvent absentes |
Implications cliniques et avancées thérapeutiques liées à l’angiogenèse tumorale
L’impact de l’angiogenèse sur la prise en charge du cancer s’est affirmé au cours des deux dernières décennies : d’abord considérée comme une curiosité biologique, elle constitue désormais une cible stratégique. Les agents anti-angiogéniques, en bloquant le VEGF ou ses récepteurs, visent à empêcher la formation de nouveaux vaisseaux indispensables à la croissance tumorale. Ce faisant, ils privent la tumeur de l’oxygène et des nutriments nécessaires à sa prolifération et ralentissent la dissémination métastatique. Toutefois, la complexité des réseaux induits expose à des limites : l’instabilité vasculaire réduit la pénétration des médicaments, un facteur à considérer lors de l’élaboration de traitements combinés (chimiothérapie, immunothérapies, etc.).
Comprendre en profondeur l’angiogenèse implique de considérer les spécificités de chaque type tumoral, le rôle du stroma et du microenvironnement. Les modèles expérimentaux modernes, qu’il s’agisse de cultures 3D ou de systèmes animaux humanisés, intègrent désormais ces paramètres pour reproduire la réalité pathologique. Cette évolution s’accompagne d’innovations comme les biomarqueurs circulants de l’angiogenèse ou l’imagerie par contraste ciblé, qui permettent de surveiller la réponse aux traitements et d’anticiper la survenue de résistances.
Pistes d’avenir et enjeux de la recherche en angiogenèse tumorale
L’avenir de la médecine oncologique passe par une analyse toujours plus fine des interactions entre cellules tumorales, cellules endothéliales et environnements vasculaires. Les thérapeutiques ciblant uniquement les facteurs de croissance se voient complétées par des approches qui modifient la sensibilité des cellules aux signaux d’angiogenèse. Des entreprises technologiques, telles que NeoVessels Biomed (créée en 2024), développent des dispositifs explorant en temps réel la perméabilité vasculaire des tumeurs chez l’humain, optimisant ainsi le choix des combinaisons thérapeutiques. Les implications éthiques et cliniques sont majeures, surtout dans la perspective d’une personnalisation accrue du traitement.
Dans ce cadre, il reste primordial de concevoir des protocoles expérimentaux capables de refléter fidèlement la variété des processus pathologiques. L’inclusion de différentes origines cellulaires, l’évaluation dynamique du microenvironnement et l’analyse du rôle du stroma sont des exigences nouvelles pour la recherche de pointe. L’angiogenèse illustre ainsi la difficulté, mais aussi l’ambition moderne de la médecine de précision.https://www.youtube.com/watch?v=qC_XTGC88Y8
- Maîtriser les fondements de l’angiogenèse s’impose autant pour la compréhension de la physiologie que pour révéler les failles à exploiter face à la maladie.
- Les avancées en imagerie et biomarqueurs affinent la prédiction de l’évolution tumorale et du succès thérapeutique.
FAQ
Qu’est-ce que l’angiogenèse et pourquoi est-elle importante ?
L’angiogenèse désigne la création de nouveaux vaisseaux sanguins à partir de vaisseaux existants. Elle joue un rôle essentiel dans le développement embryonnaire, la cicatrisation et la réparation tissulaire, mais aussi dans des processus pathologiques comme la progression du cancer.
Comment l’angiogenèse favorise-t-elle la croissance des tumeurs ?
Les tumeurs stimulent l’angiogenèse par la sécrétion de facteurs comme le VEGF, induisant la formation de vaisseaux sanguins supplémentaires qui apportent l’oxygène et les nutriments nécessaires à leur expansion et facilitent la dissémination de cellules cancéreuses.
Quels sont les principaux types de vaisseaux formés lors de l’angiogenèse tumorale ?
On distingue le bourgeonnement de vaisseaux préexistants, le mimétisme vasculaire par les cellules tumorales, et la division/invagination de segments vasculaires. Ces formes contribuent à la diversité et à l’anarchie des réseaux vasculaires dans les tumeurs.
Quelles sont les conséquences des vaisseaux tumoraux sur l’efficacité des traitements ?
Les vaisseaux tumoraux, souvent anormaux et perméables, entraînent une mauvaise distribution des traitements anticancéreux, limitant leur efficacité. De plus, leur instabilité peut favoriser les métastases et compliquer la réponse médicale.
Des avancées récentes ont-elles amélioré le ciblage de l’angiogenèse en cancérologie ?
Oui, le développement de biomarqueurs, d’imagerie ciblée et de thérapeutiques modulant finement le microenvironnement vasculaire permettent d’affiner la prise en charge et d’augmenter les chances de succès des traitements contre la vascularisation tumorale.